11 Ott Simulare le aritmie cardiache? Da oggi si può!!
Ciao a tutti WWE-followers! Pronti per una nuova lettura/avventura??
Ebbene, il secondo appuntamento della rubrica dedicata al mondo della Cardiologia, nonché delle numerose innovazioni tecnologiche in tale ambito, ci porta ad approfondire la complessità della microstruttura cardiaca, considerata una delle principali determinanti di un substrato aritmogeno.
Lo studio che sto per presentarvi, pubblicato sulla rivista Scientific Reports, è stato condotto da un gruppo di ricercatori del MIPT (Moscow Institute of Physics and Technology) e dell’Università di Ghent (Belgio) con lo scopo di sviluppare il primo modello matematico realistico in grado di descrivere la formazione del tessuto cardiaco.
Al fine di comprendere a pieno le dinamiche del suddetto studio occorre, tuttavia, procedere per gradi.
In primis, specifichiamo che l’involucro muscolare del cuore, detto miocardio o muscolo cardiaco, è composto per il 70% da fibre muscolari e per un restante 30% principalmente da tessuto connettivo e da vasi. In particolare, le fibre muscolari sono caratterizzate da una striatura trasversale analoga a quella delle fibre muscolari scheletriche ma la contrazione è di tipo involontaria, controllata, cioè, dal sistema nervoso autonomo.
 Fig1. Post 2. Rappresentazione del miocardio, con il tipico decorso delle fibre
Fig1. Post 2. Rappresentazione del miocardio, con il tipico decorso delle fibre
A svolgere la funzione elettromeccanica del cuore sono le cellule dette cardiomiociti (CM) ma il tessuto cardiaco contiene anche cellule non eccitabili, incapaci cioè di eccitazione elettrica, come i fibroblasti (FB). Oltre a quest’ultimi, esistono proteine extracellulari strutturali (ad es. Collagene) responsabili della formazione della matrice extracellulare (ECM), essenziali per un corretto funzionamento meccanico del cuore e per una continua propagazione del segnale elettrico.
Nel dettaglio, i miocardiociti sono cellule a bassissima capacità proliferativa, pertanto, la loro necrosi, come quella che si verifica nell’infarto, viene riparata con una cicatrice fibrosa. Piccoli infarti multipli e disseminati possono portare alla formazione di tessuto connettivo fibroso in eccesso, detta fibrosi miocardica, che ha, come principali conseguenze, la ridotta mobilità delle pareti e la diminuita forza di contrazione, nonchè, limitatamente al tessuto di conduzione, aritmie e perfino blocchi di conduzione.
Ed è proprio sulla relazione tra la morfologia del tessuto cardiaco e lo sviluppo di aritmie cardiache che i ricercatori hanno posto l’attenzione, attenendosi, inoltre, al fatto che, secondo l’Organizzazione Mondiale della Sanità, le malattie cardiovascolari rappresentano il maggior numero di morti a livello mondiale. Circa il 40% di queste morti si verificano improvvisamente e sono causate da aritmia, ovvero un gruppo di condizioni in cui il battito cardiaco è irregolare.
A questo punto, è chiaro che l’interazione tra CM, FB e proteine extracellulari porta alla formazione di una struttura tissutale complessa che, in presenza della maggior parte delle malattie cardiache, cambia attraverso un processo detto rimodellamento e considerato, inoltre, uno dei principali determinanti di aritmogenicità nel tessuto cardiaco. Tali cambiamenti, tuttavia, non sono facili da osservare e non esiste alcun metodo diretto per studiarli nei pazienti.
Così, il gruppo di ricercatori ha pensato ad un approccio alternativo per comprendere i principi della formazione del tessuto cardiaco normale ed anormale, insieme alla possibilità di prevederne i cambiamenti durante il rimodellamento, elaborando, pertanto, un modello matematico ad hoc di formazione dei tessuti strutturali.
A tale scopo, i ricercatori hanno dapprima raccolto dati sperimentali sulle due forme cellulari cardiache sopra descritte, CM e FB, e, successivamente, hanno condotto esperimenti su cardiomiociti e fibroblasti ventricolari di un ratto neonatale, coltivando tali cellule su di uno scaffold nanofibroso polimerico, volto ad emulare la funzione della matrice extracellulare, al fine di riprodurre efficacemente l’anisotropia del tessuto cardiaco. Questo tessuto cardiaco progettato presenta, dunque, una struttura complessa risultante da interazioni tra cellule e cellule-substrato. Tuttavia, durante lo sviluppo del modello, sono state prese in considerazioni anche situazioni sperimentali più semplici caratterizzate dall’assenza di interazione cellulare, ove la densità di tali cellule era ridotta al minimo, o del tipo cellula-substrato, impiegando uno scaffold uniforme e senza fibre, di modo che le cellule potessero diffondersi ugualmente in tutte le direzioni. La situazione appena descritta potrebbe essere meglio compresa con rifermento alla figura seguente.
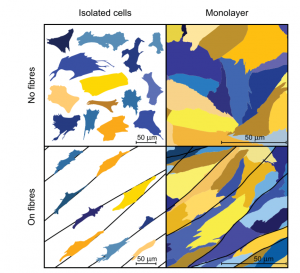
Fig 2. Post2. Casi Sperimentali
Considerando i CM riportati in giallo ed i FB in blu, nella prima colonna è possibile osservare l’insieme delle cellule isolate seminate ad un livello di bassa densità per evitarne l’interazione. La seconda colonna, invece, rappresenta le cellule sul monolayer. Il substrato è isotropico nella fila superiore, mentre in quella inferiore vi è l’aggiunta di nanofibre.
Le cellule che crescono su di uno scaffold di nanofibre sono costrette ad allungarsi in una direzione che consente una migliore riproduzione della tessitura del tessuto muscolare cardiaco. Di conseguenza, i ricercatori hanno ottenuto dati statistici sulle forme dei FB e dei CM nonchè sulla loro interazione.
Al fine di osservare la propagazione delle onde di eccitazione, i ricercatori hanno stimolato con un elettrodo le cellule nella coltura, imitando la propagazione delle onde nel tessuto cardiaco virtuale e scoprendo che il modello di propagazione dell’onda riproduce con precisione il comportamento osservato sperimentalmente per entrambi i casi (isotropici e anisotropici). Ciò significa che il modello proposto può infatti essere utilizzato per studiare le proprietà del tessuto cardiaco ed i vari fattori di rischio per le aritmie.
Certo, i tentativi di simulare la propagazione delle onde nel tessuto cardiaco sono stati realizzati anche in precedenza ma si tratta di semplici modelli che non riproducono la complessità delle forme cellulari ed in cui le cellule cardiache, in tutte le simulazioni, sono organizzate in maniera casuale. Nello studio appena descritto, invece, i ricercatori hanno considerato sia le forme che l’interazione tra le cellule, rendendo così le loro simulazioni al computer più accurate e realistiche.
Konstantin Agladze del Mipt spiega che: “Il modello che abbiamo proposto può prevedere gli stessi modelli di propagazione delle onde che abbiamo osservato nei nostri campioni sperimentali, il che significa che può essere utilizzato per aiutarci ad imparare a prevedere la probabilità con cui un paziente svilupperà l’aritmia. Basterà solo variare le condizioni in cui un tessuto si è formato e vedere quali sono le possibilità di sviluppare l’aritmia all’interno del tessuto stesso”.
Il modello descritto è attualmente nella fase iniziale del suo sviluppo e ci sono diversi fattori da considerare, come il fatto stesso che si tratta di un modello bidimensionale e non 3D come l’organo stesso. Questo significa sì che i ricercatori hanno ancora tanto da perfezionare ma a loro va il merito di aver aperto nuove strade e possibilità nella descrizione dei tessuti all’interno degli organismi viventi.
Let you know!
- https://www.nature.com/articles/s41598-017-07653-3.pdf
- http://www.corriere.it/salute/dizionario/miocardio/gallery.shtml?pic=1
- http://www.treccani.it/enciclopedia/fibrosi_%28Universo-del-Corpo%29/
Le testimonianze dei ricercatori dello studio potete trovarle qui.



No Comments